Seperti dijelaskan sebelumnya (disini), salah satu ukuran kinerja reaktor elektrolisa (elektroliser) industri adalah efisiensi faraday. Penyebut dalam persamaan efisiensi faraday adalah massa teoritis dari hukum Faraday. Di sini akan dibahas mengenai hukum Faraday, yang merupakan hubungan antara jumlah arus yang mengalir melalui sirkuit luar dan jumlah bahan yang dikonsumsi atau dihasilkan dalam reaksi setengah sel. Untuk mengeksplorasi bagaimana ini bekerja, pandang reaksi seng
Zn(s) —> Zn2+(aq) + 2e– (1)
Dari persamaan setengah sel tampak bahwa dua elektron dihasilkan untuk setiap atom seng yang bereaksi. Pada umumnya lebih mudah mengerjakan ini dalam istilah mol daripada atom. Jadi, dua mol elektron akan dihasilkan untuk setiap mol atom seng yang dioksidasi. Di sini terlihat bahwa lebih mudah menghubungkan mol elektron dengan mol yang bereaksi atau yang dihasilkan untuk sembarang spesies dalam reaksi setengah sel yang diberikan.
Langkah berikutnya adalah menghubungkan mol elektron dengan arus yang terukur melalui sirkuit luar. Untuk melakukan ini biasanya diperkenalkan satuan muatan baru – ekivalen. Ekivalen didefinisikan sebagai mol muatan (bisa muatan positif atau muatan negatif, tidak masalah). Jumlah ekivalen suatu senyawa secara sederhana adalah jumlah zat (dalam mol) dikalikan dengan nilai absolut muatannya, zi. Sebagai contoh, satu mol Na+ adalah 1 ekivalen, sedangkan satu mol Ca2+ akan menjadi 2 ekivalen. Karena tanda muatan tidak masalah, satu mol elektron sama dengan 1 ekivalen muatan.
Arus luar dinyatakan dalam ampere [A atau C s-1]. Dengan demikian, diperlukan hubungan antara coulomb [C] dan ekivalen. Hubungan ini disebut tetapan Faraday, F, yang mempunyai nilai 96.485 C/ekivalen. Tetapan Faraday juga dinyatakan dalam istilah dua tetapan lain: satuan dasar muatan, q, dan bilangan Avogadro, NA,
F = qNA (2)
Persamaan ini adalah cara lain yang menyatakan bahwa ekivalen adalah mol muatan, karena q adalah jumlah muatan pada proton dalam coulomb. Hubungan antara arus, I [A], dan muatan total yang dialirkan dalam coulomb juga diperlukan. Hubungan itu adalah
dimana Q adalah muatan dalam [C], I dalam [A] dan t dalam [s]. Pada keadaan dimana arus adalah konstan, Persamaan (3) menjadi
Q = It (4)
Potongan-potongan yang diperlukan untuk menuliskan hubungan antara arus dalam sirkuit luar dan jumlah zat yang direaksikan atau dihasilkan telah didapat. Penerapan ini untuk elektroda seng di atas diilustrasikan dalam Ilustrasi 1.
Untuk oksidasi seng, arus 12 A mengalir selama 2 jam. Berapa banyak seng bereaksi? Berikan jawaban dalam istilah massa dan mol seng. Reaksi adalah
Zn(s) –> Zn2+(aq) + 2e–
Pertama, muatan total yang lewat ditentukan dari Persamaan (4)
Q = It = 12[C]/[s] x 2[h] 3600[s]/[h] = 86.400 [C]
Jumlah mol seng berbanding lurus dengan muatan yang dilewatkan. Dari stoichiometri reaksi oksidasi, untuk setiap mol seng dua mol elektron dilepaskan. Jadi,
nZn = Q/(2F) = 86400[C]/(2[ekiv/mol] 96845[C/ekiv]) = 0,448 mol Zn
Massa seng yang dikonsumsi gampangnya adalah mol kali berat molekul:
mZn = MZnnZn = (65,38)(0,448) = 29,3 g Zn
Ilustrasi 1
Sekarang apa yang telah dikerjakan di atas dibuat menjadi umum. Sembarang reaksi setengah sel dapat dinyatakan dalam bentuk berikut:
dimana si adalah koefisien stoichiometri untuk spesies i, yang dapat positif atau negatif, Ai adalah simbol untuk spesies khusus (mis.: Zn2+), dan n adalah jumlah elektron yang terlibat dalam reaksi. Massa spesies i yang dikonsumsi atau dihasilkan sama dengan
dimana Mi adalah berat molekul spesies i. Persamaan ini dikenal sebagai hukum Faraday. Koefisien stoichiometri dengan hati-hati telah dimasukkan dalam Persamaan (6). Akan tetapi, hukum Faraday paling sering ditulis sebagai
Ketika menggunakan bentuk persamaan ini, n mewakili jumlah elektron per spesies i.
Meskipun Persamaan (6) dan (7) bermanfaat, aspek penting dari uraian di sini adalah proses yang digunakan untuk mengembangkan persamaan. Dimulai dengan muatan Q dalam satuan standar [C], yang kemudian dihubungkan dengan arus dalam [A] sebagai fungsi waktu. Muatan tersebut kemudian dikonversi ke mol elektron (ekivalen). Mol elektron kemudian dihubungkan melalui reaksi setengah sel dengan mol spesies i yang direaksikan atau dikonsumsi. Akhirnya, berat molekul digunakan untuk mengkonversi mol ke massa spesies yang diinginkan.
Prosedur serupa dapat digunakan untuk menghitung besaran seperti mol total yang bereaksi, kecepatan reaksi molar atau fluks molar karena reaksi pada permukaan. Pemakaian hukum Faraday dan prosedur yang lebih umum yang digunakan untuk menurunkannya didemonstrasikan dalam Ilustrasi 2.
Untuk baterai asam-timbal, hitung kecepatan dimana Pb bereaksi dan H+ dikonsumsi untuk sel yang beroperasi pada 20 [A]. Nyatakan kecepatan reaksi dalam istilah kecepatan reaksi molar.
Reaksi keseluruhan untuk pemakaian/pengosongan adalah
Pb + PbO2 + 2H2SO4 –> 2PbSO4 + 2H2O
Reaksi pada elektroda positif adalah
PbO2 + SO42- + 4H+ + 2e– –> PbSO4 + 2H2O
Pada elektroda negatif
Pb + SO42- –> PbSO4 + 2e–
Kecepatan reaksi molar konsumsi Pb (timbal) diperoleh dari Persamaan (7), Q diganti dengan I untuk mengubah menjadi kecepatan, dan berat molekul tidak dibutuhkan:
Kecepatan reaksi molar Pb = I/(2F) = 20/(2F) = 1,04 x 10-4 mol s-1
Kecepatan reaksi molar H+ juga diperoleh dari Persamaan (7) dengan cara serupa. Akan tetapi, nilai n berbeda, yang dalam hal ini adalah 2 ekivalen muatan (2 elektron dalam reaksi setengah sel) untuk setiap 4 mol H+. Jadi, n untuk H+ adalah 2/4 atau 1/2 [ekiv mol-1 H+].
Kecepatan reaksi molar H+ = I/(F/2) = (2)20/F = 4,15 x 10-4 mol s-1
Catat bahwa ion sulfat dihasilkan pada kedua elektroda. Berdasarkan pada stoichiometri untuk reaksi keseluruhan, diharapkan 2 mol ion sulfat dikonsumsi untuk setiap mol Pb. Atau, dapat dikatakan bahwa satu mol elektron bereaksi untuk setiap mol sulfat. Formalnya, ini ditulis sebagai
Kecepatan reaksi molar SO42- = I/(nF) = 20/F = 2,07 x 10-4 mol s-1
Ilustrasi 2
Terakhir, perlu dicatat bahwa reaktan dan produk bisa bermuatan atau netral. Mereka juga dapat mengambil beberapa bentuk, seperti spesies terlarut dalam elektrolit, padatan yang mengendap pada elektroda, atau gas. Ilustrasi 2 melibatkan produk reaksi padat PbSO4(s). Sekarang pandang oksidasi ion khlorida dalam larutan membentuk gas khlor:
2Cl– —> Cl2 + 2e– (8)
Dua ion khlorida dari larutan masing-masing menyerahkan satu elektron dan mereka bergabung pada permukaan logam membentuk gas.
Arus 20 [A] mengalir selama 10 menit. Berapa gram gas khlor dihasilkan dengan menganggap Persamaan (8) mewakili reaksi elektroda? Untuk perilaku gas ideal, berapa volume gas mewakili ini pada tekanan atmosfer (100 kPa) dan pada 25oC?
Menggunakan Persamaan (6), n = 2, sCl2 = 1, MCl2 = 70,906 g mol-1:
mi = (Mi/2)(Q/F) = (70,906x20x10x60)/(2×96485) = 4,41 g
Massa Cl2 dikonversi menjadi mol (4,41/70,906), dan hukum gas ideal (pV = nCl2RT) digunakan untuk menentukan volume:
V = (mi/Mi)RT/p = (4,41/70,9068)(8,314)(298)/100.000 = 0,0015 m3
Ilustrasi 3


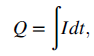
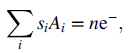
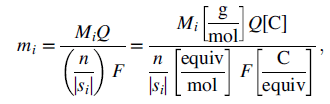

Leave a comment