Ketika memperkirakan efisiensi arus dalam reaktor elektrokimia (disini), elektrokinetika reaksi, yang dalam contoh menggunakan persamaan Butler-Volmer (BV) dan Tafel, harus ditentukan/diketahui. Berbeda dengan reaksi kimia biasa, kinetika reaksi elektrokimia umumnya dinyatakan sebagai hubungan antara rapat arus sebagai fungsi potensial. Untuk menjelaskan hubungan tersebut, pandang reaksi redoks elementer satu elektron
O + e– <—> R
(1)
dimana O adalah spesies yang dioksidasi dan R adalah spesies yang direduksi. Keduanya, reaksi maju (dalam hal ini, reduksi) dan reaksi balik (dalam hal ini, oksidasi) berlangsung secara serempak pada permukaan elektroda yang sama. Pada potensial kesetimbangan, kecepatan reaksi bersih adalah nol, sedangkan reaksi anodik mendominasi pada potensial V positif, dan reaksi katodik mendominasi pada potensial V negatif. Menurut perjanjian, arus anodik didefinisikan sebagai positif dan arus katodik negatif.
Seperti halnya reaksi kimia, agar reaksi terjadi, ada hambatan energi yang harus diatasi, yang biasanya disebut energi aktivasi. Untuk reaksi maju, dengan menganggap reaksi adalah elementer orde satu, hubungan antara kecepatan reaksi dan energi aktivasi dapat ditulis sebagai
dimana co adalah konsentrasi spesies yang dioksidasi. Penurunan dalam beda energi Gibbs DGf* (baca ‘Delta Gf) berkaitan dengan energi aktivasi yang lebih rendah dan akan menyebabkan kecepatan reaksi maju meningkat. Persamaan serupa dapat dituliskan untuk reaksi balik.
Agar dapat dengan mudah diterapkan, Persamaan (2) biasanya dinyatakan sebagai kecepatan reaksi katodik dan anodik dalam istilah potensial V. Kecepatan reaksi katodik dapat dinyatakan sebagai
b (baca beta) adalah fraksi perubahan energi total yang memengaruhi energi aktivasi untuk reaksi katodik dan (1 – b) fraksi yang memengaruhi reaksi anodik; F, R dan T adalah tetapan Faraday, tetapan universal gas dan suhu. Persamaan ini dapat digunakan untuk menuliskan persamaan dalam istilah rapat arus. Arah arus katodik adalah dari larutan ke elektroda (elektron bergerak dalam arah yang berlawanan dengan arus, atau dalam hal ini, dari elektroda ke spesies yang direduksi). Dengan perjanjian ini, kecepatan reaksi untuk katoda adalah
dan untuk anoda
Pada potensial kesetimbangan U, arus bersih adalah nol dan besar arus katodik sama dengan arus anodik. Nilai rapat arus pada kesetimbangan ini didefinisikan sebagai rapat arus pertukaran (exchange-current) io (ingat arus bersih adalah nol). Jadi,
Jika Persamaan (5) dikali dan dibagi dengan persamaan anodik untuk io, persamaan berikut didapatkan
yang disederhanakan menjadi
Untuk rapat arus katodik persamaan menjadi
Gaya pendorong untuk reaksi di atas adalah overpotensial permukaan hs (baca eta s) yang didefinisikan sebagai
dimana V dan U adalah potensial dan potensial kesetimbangan relatif terhadap elektroda acuan yang sama yang terletak tepat di luar lapisan ganda.
Persamaan untuk rapat arus bersih dapat diperoleh dengan menggabungkan Persamaan (8), (9) dan (10):
Persamaan ini dikenal dengan persamaan Butler-Volmer (BV), yang ditunjukkan di sini adalah untuk reaksi elementer yang melibatkan transfer elektron tunggal. Nilai beta untuk jenis reaksi ini umumnya ~0,5.
Bentuk Persamaan (11) adalah berguna untuk menggambarkan berbagai macam reaksi elementer dan nonelementer dan digunakan secara luas dalam teknik elektrokimia. Persamaan ini dapat dibuat umum dengan mendefinisikan koefisien transfer anodik dan katodik alfa a dan alfa c menghasilkan
yang merupakan bentuk persamaan BV yang sering digunakan. Jika kedua koefisien dijumlahkan, hasilnya adalah sama dengan jumlah elektron yang ditransfer dalam reaksi, n.


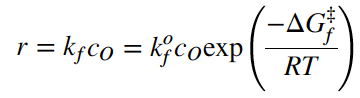
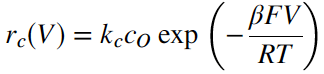

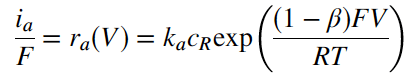
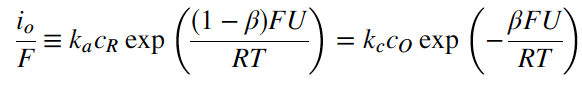

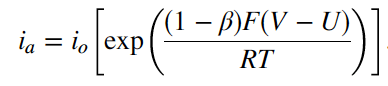


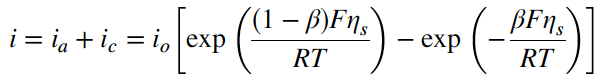

Leave a comment